MDCG und AIB veröffentlichen den Leitfaden zur Wechselwirkung zwischen der MDR/ IVDR und dem KI-Gesetz

MDCG 2025-6 und AIB 2025-1, veröffentlicht am 19. Juni 2025, legen das Zusammenspiel zwischen EU MDR/IVDR und AI Act fest.
Europäische Kommission veröffentlicht aktualisierte Version der Leitlinie MDCG 2019-11 zur Qualifikation und Klassifikation von Software gemäß MDR und IVDR

EU aktualisiert MDCG 2019-11 Leitfaden zur Qualifizierung und Klassifizierung von Software für Medizinprodukte.
MDCG 2025-4: Neue EU-Leitlinie zur Gewährleistung der sicheren Bereitstellung von Software für Medizinprodukte über Online-Plattformen

Die Europäische Kommission hat am 16.06.2025 die Leitlinie MDCG 2025-4 zur sicheren Bereitstellung von Medizinprodukte-Software-Apps auf Online-Plattformen veröffentlicht.
Team-NB veröffentlicht Pressemitteilung über “Certificates with Conditions”

Am 12. März 2025 hat das TEAM NB eine Pressemitteilung über Zertifikate herausgebracht, für die besondere Bestimmungen, Vorschriften oder gar Einschränkungen gemäß EU MDR 2017/745 / EU IVDR 2017/746 Anhang VII Abschnitt 4.8 geltend gemacht werden können.
Erste Änderung der ISO 15223-1 zu Symbolen zur Kennzeichnung von Medizinprodukten veröffentlicht
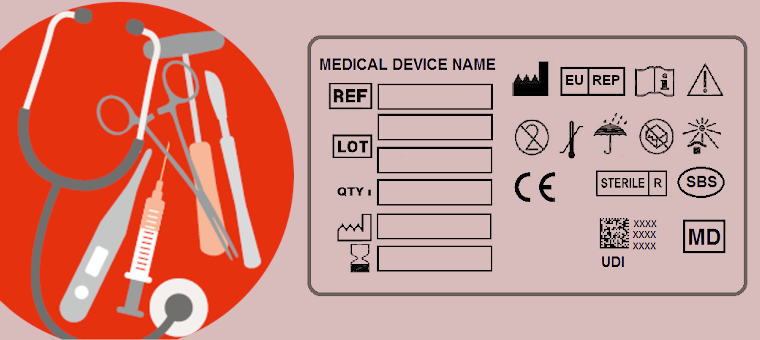
Die harmonisierte Norm ISO 15223-1 standardisiert Symbole, die die Hersteller von Medizinprodukten zur Kennzeichnung und zur Übermittlung wichtiger Informationen verwenden sollten.
Aktualisierung der Medizinprodukte-Betreiberverordnung (MPBetreibV) und Medizinprodukte-Abgabeverordnung (MPAV)

Deutschland aktualisiert die Medizinprodukte-Betreiberverordnung (MPBetreibV) und Medizinprodukte-Abgabeverordnung (MPAV)
Neue Verordnung (EU) 2025/40 über Verpackungen und Verpackungsabfälle

Die EU verabschiedet eine neue Verordnung (EU) 2025/40 über Verpackungen und Verpackungsabfälle und führt damit strengere, auf die Kreislaufwirtschaft ausgerichtete Verpflichtungen ein.
MDCG Guidance Alert: Neuer Leitfaden MDCG 2024-16 zum Umgang mit Unterbrechung oder Einstellung

Das neu veröffentliche MDCG-Dokument enthält ein Informationsformular für Hersteller zum Ausfüllen im Falle einer Unterbrechung der Lieferkette oder der Einstellung der Produktion von Medizinprodukten oder IVDs.
MDCG 2022-5 Rev. 1: Aktualisierung der Leitlinie zu Borderline-Produkten

Die überarbeitete MDCG 2022-5 Rev.1 zielt darauf ab, die Klassifizierung von Grenzprodukten durch neue Beispiele und Erklärungen zu verbessern.
MDCG 2024-13: Regulatorischer Status von Ethylenoxid (EtO) für die Sterilisation von Medizinprodukten

MDCG 2024-13: EtO unterliegt der MDR/IVDR, obwohl EtO als Stoff selbst keine zusätzliche MDR/IVDR-Konformitätsbewertung erfordert.



