Team-NB aktualisiert den Leitfaden zur Einreichung der Technischen Dokumentation für Medizinprodukte

Team-NB aktualisiert den Leitfaden zur Einreichung der Technischen Dokumentation für Medizinprodukte 2. Mai 2023 Am 19. April 2023 veröffentlichte the European Association of Medical devices Notified Bodies, kurz Team-NB, Version 2 der Stellungnahme “Best Practice Guidance for the Submission of Technical Documentation under Annex II and III of Medical Device Regulation (EU) 2017/745”. Der Leitfaden […]
gempex und SCC – eine Partnerschaft für die Medizintechnik-Industrie
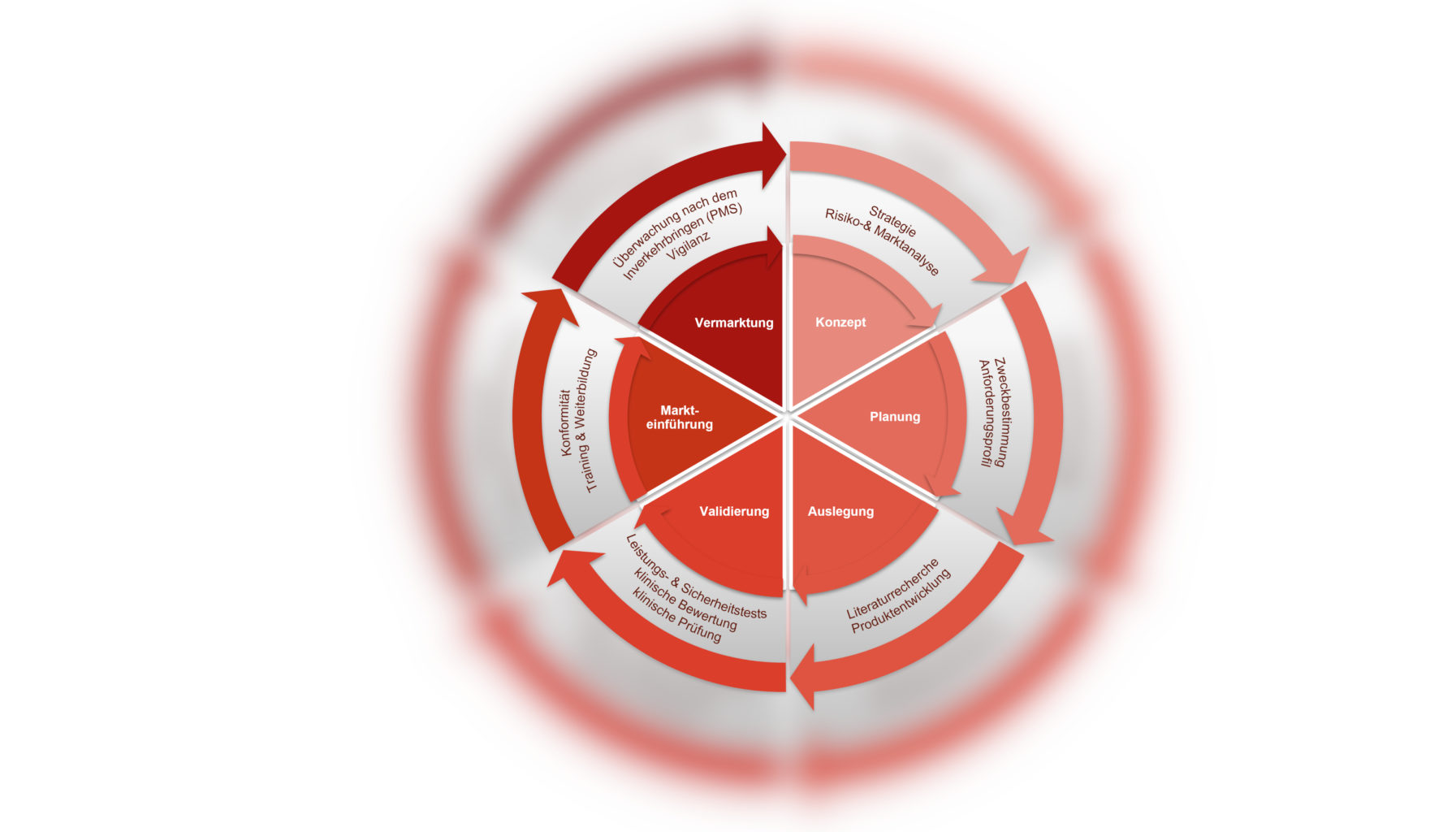
Jeder Partner hat seine Stärken!
Europäische Kommission verlängert die Übergangsfristen der MDR

Am 7. März 2023 hat der Rat der Europäischen Union den Vorschlag der Kommission zur Verlängerung der Übergangsfristen der MDR angenommen.
MDCG-Leitfaden zu Klassifizierungsregeln für IVDs aktualisiert
Am 10. Februar 2023 wurde der aktualisierte Leitfaden zu Klassifizierungsregeln für In-vitro-Diagnostika veröffentlicht.
Neuer MDCG Leitfaden – Fragen und Antworten zu Begriffen und Konzepten der Vigilanz gemäß MDR verfügbar

Seit 14. Februar 2023 ist der MDCG Leitfaden zu Begriffen und Konzepten der Vigilanz gemäß MDR verfügbar.
MDCG Leitfaden zur Anwendung von Artikel 5(5) der MDR auf in-house Medizinprodukte veröffentlicht

MDCG veröffentlicht den Leitfaden zur Anwendung der im Artikel 5(5) der MDR enthaltenen Vorschriften für die Herstellung und Verwendung in-house Medizinprodukte.
Durchführungsverordnung (EU) 2022/2346 und 2022/2347 zur MDR veröffentlicht
Durchführungsverordnung (EU) 2022/2346 legt für alle Produktgruppen in Anhang XVI der MDR ohne medizinische Zweckbestimmungen Spezifikationen fest.
EU-Kommission nimmt Vorschlag eines längeren Übergangszeitraum für die Umstellung auf die MDR an

Längere Übergangszeiten gelten für Produkte mit höherem Risiko bis zum 31.12.2027, mit mittlerem und geringerem Risiko bis zum
31.12.2028, für implantierbare Sonderanfertigungen der Klasse III bis zum 26. Mai 2026.
Leitfaden zur angemessenen Überwachung im Hinblick auf die Übergangsbestimmungen gemäß Art.120 der MDR aktualisiert

Medizinprodukte mit gültigen Bescheinigungen dürfen nach dem Geltungsbeginn der MDR und bis spätestens 26. Mai 2024 unter bestimmten Bedingungen in Verkehr gebracht oder in Betrieb genommen werden.
Leitfaden für den Periodic Safety Update Report gemäß MDR veröffentlicht

Das veröffentlichte Dokument MDCG 2022-21 dient als Leitfaden für die Umsetzung der in Artikel 86 der MDR festgelegten Anforderungen zur Überprüfung aller Daten aus der Überwachung nach dem Inverkehrbringen von Medizinprodukten.


